S.Abi Najm1, S. Lysitsa1
J.-P. Carrel1, P. Lesclous2
T.Lombardi1, J.Samson
Summary
Bisphosphonates-related jaw osteonecrosis
Introduction The latest generations of bisphosphonates constitute
a major advance in the management of disorders including Paget’s
disease, osteoporosis, and osteolytic bone tumors. Recent reports
describe numerous cases of osteonecrosis of the jaw in patients
treated with bisphosphonates. Some of these reports mention
predisposing factors, including surgical procedures, chemotherapy,
and radiotherapy.
Cases In the past 12 months, we have observed and treated 9 cases
of maxillary osteonecrosis, which we present summarily.
Discussion Some of our cases (3 of 9), like many of those described
in literature, do not present predisposing factors. The osteonecrosis
may thus be due mainly to the effect of bisphosphonates that, by
blocking bone remodeling, may cause excessive bone
mineralization. If this hypothesis is confirmed, these cases of
osteonecrosis may be due to excess doses. Better dose adjustment
should thus help prevent this complication.
S. Abi Najm, S. Lysitsa, J.-P. Carrel,
P. Lesclous, T. Lombardi, J. Samson
Presse Med 2005; 34: 1073-7
© 2005, Masson, Paris
Résumé
Introduction Les bisphosphonates de dernières générations
constituent un progrès important dans la prise en charge de
certaines affections: maladie de Paget, ostéoporose et tumeurs
osseuses ostéolytiques. Plusieurs cas d’ostéonécrose des maxillaires
viennent d’être rapportés chez des patients sous bisphosphonates.
Des facteurs favorisants ont été évoqués: intervention chirurgicale,
chimiothérapie, radiothérapie, etc.
Observations En 12 mois, 9 cas d’ostéonécrose des maxillaires ont
été observés et traités; ils sont présentés de façon synoptique.
Discussion Comme dans la littérature, dans plusieurs des cas
rapportés (3 sur 9), on ne trouve aucun facteur favorisant. On peut
donc se demander si l’ostéonécrose ne serait pas principalement
due à l’effet des bisphosphonates qui, en bloquant le remodelage
osseux, entraînerait une minéralisation excessive de l’os. Si cette
hypothèse se confirmait, l’ostéonécrose résulterait d’un surdosage
et une meilleure adaptation de la posologie devrait permettre
d’éviter cette complication
Les bisphosphonates sont des analogues structuraux
des pyrophosphates inorganiques, principalement
prescrits pour inhiber l’activité des ostéoclastes.
Selon que le radical contient ou non un atome
d’azote, on distingue 2 formes de bisphosphonates: les
bisphosphonates sans groupe amine (clodronate, étidronate,
tiludronate, etc.) et les aminobisphosphonates
(pamidronate, risédronate, alendronate, ibandronate,
zolédronate, etc.) qui représentent les produits de dernières
générations1.Tous les bisphosphonates commercialisés
ne sont pas métabolisés.
Les aminobisphosphonates ont de multiples actions:
• après avoir adhéré à l’hydroxyapatite de la trame
osseuse minérale, ils sont absorbés sélectivement par
les ostéoclastes, ce qui aurait pour effet d’induire leur
apoptose2;
• ils ont une action anti-tumorale propre3;
• ils ont une action anti-inflammatoire en inhibant
certaines cytokines4;
• ils ont une action anti-angiogénique5.
En 3 décennies, les indications des bisphosphonates
se sont progressivement élargies: après avoir été initialement
utilisés dans la maladie osseuse de Paget, ils
sont actuellement prescrits pour le traitement et la
prévention de l’ostéoporose6,7, pour le traitement de
l’hypercalcémie maligne et des tumeurs osseuses
d’origine hématologique ou métastatique8,9 qui s’accompagnent
d’une ostéolyse, et plus récemment pour
le traitement de la nécrose aseptique de la hanche10,
du syndrome Sapho4, etc. Ils contribuent à traiter les
symptômes liés à ces différentes affections et ils sont
souvent prescrits au long cours, surtout en carcinologie.
L’ostéonécrose des maxillaires, secondaire à la
prise de bisphosphonates, est une complication
décrite récemment dans la littérature11-17.
En 12 mois, 9 cas d’ostéonécrose ont été découverts
dans la division de stomatologie, de chirurgie orale et
radiologie dento-maxillo-faciale de la Faculté de Médecine
de Genève.
Observations
Le premier patient (cas n°1) avait une ostéonécrose
maxillaire, secondaire à la prise de bisphosphonates.
Venu consulter pour une infection d’origine dentaire,
le tableau clinique s’est avéré atypique et l’os alvéolaire
périradiculaire semblait nécrosé. Après extraction
des 2 dents causales qui étaient les seules dents
maxillaires restantes, l’évolution n’a pas été favorable
et on a observé une exposition osseuse s’étendant
progressivement. Elle a nécessité la réalisation d’une
maxillectomie subtotale; l’examen histopathologique
a confirmé le diagnostic d’ostéonécrose.
En 12 mois, 8 autres cas ont été observés.
Ces 9 patients étaient 3 hommes et 6 femmes dont
l’âge était compris entre 45 et 85 ans (âge moyen
73 ans) (tableau 1). Les bisphosphonates ont été
prescrits pour le traitement des affections suivantes:
myélome multiple, cancer du sein, adénocarcinome
prostatique, ostéoporose. Dans ces 9 cas, on a observé
12 foyers d’ostéonécrose dont les localisations étaient
les suivantes : 7 atteintes mandibulaires (dont une
double localisation), 3 maxillaires et 1 bimaxillaire.
Cinq foyers d’ostéonécrose sont apparus après une
extraction dentaire, 1 après ablation d’implants dentaires
et 6 spontanément.
Cliniquement, l’atteinte osseuse ressemblait plus à
une ostéoradionécrose qu’à une ostéomyélite: exposition
osseuse, spontanée ou provoquée, le plus souvent
après extraction dentaire, sans aucune tendance
à guérir spontanément car le séquestre ne se détache
pas et l’atteinte osseuse semble s’étendre (figure 1).
Le bilan radiologique comporte systématiquement un
orthopantomogramme (figure 2), parfois un examen
tomodensitométrique (figure 3), une scintigraphie
osseuse (figure 4).
Dans chaque cas, l’examen histopathologique a
confirmé le diagnostic de nécrose osseuse; aucune
cellule tumorale n’a été observée (figure 5) lorsque
le traitement avait été prescrit pour une tumeur
maligne.
Dans tous les cas, on a réalisé une séquestrectomie
après une antibiothérapie (amoxicilline 750 mg 3xj-1
et métronidazole 250 mg 3xj-1) de 7 à 10 jours en
moyenne, temps nécessaire pour obtenir une cicatrisation
muqueuse suffisante.
Commentaires
Les bisphosphonates, molécules utilisées depuis les
années 1970, constituent un progrès thérapeutique
important pour le traitement de la maladie de Paget18,
de l’ostéoporose6,7 et des tumeurs osseuses ostéolytiques
8,9. Ils réduisent de façon importante (de 20 à
60 % selon les auteurs) la fréquence des manifestations
liées à l’atteinte osseuse, en diminuant les douleurs,
les fractures pathologiques, les compressions
radiculaires ou médullaires et les épisodes d’hypercalcémie
8. Leurs indications sont de plus en plus
vastes et on estime que 2,5 millions de patients ont
été traités par pamidronate et zolédronate depuis leur
mise sur le marché19.
La Food and Drug Administration (FDA) a donné l’autorisation
de mise sur le marché (AMM) au pamidronate
en 1994, pour le zolédronate en 2001; en France,
les AMM ont été obtenues quelques mois plus tard.
Les maxillaires semblent les seules structures
osseuses touchées; ceci pourrait s’expliquer par une
continuité de la muqueuse de recouvrement qui mettrait
en relation l’os avec le milieu septique de la
cavité buccale.
Le développement de l’ostéonécrose survenait après
un acte chirurgical, le plus souvent une extraction
dentaire, ou de façon apparemment spontanée. Le
traitement proposé dépend de la localisation des
lésions et de leur dimension.
Aucun cas n’a été traité par oxygénothérapie hyperbare
dont l’efficacité semble aléatoire14,16.
Les limites du séquestre sont difficiles à évaluer car
l’os “sain” périphérique apparaît très remanié et peu
vascularisé; si la séquestrectomie est insuffisante, l’exposition
osseuse persiste ou récidive. Sauf contre-indications
d’ordre général, il n’y a aucune raison de laisser
évoluer un foyer d’ostéonécrose.
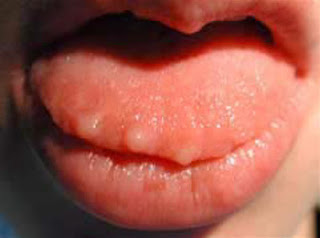
Figure 1 Ostéonécrose dans la région maxillaire antérieure (cas n° 1) : exposition
osseuse qui s’est étendue progressivement après l’extraction de deux dents restantes
et ayant nécessité la réalisation d’une maxillectomie subtotale.
Figure 2 Orthopantomogramme (cas n° 2) : perte spontanée de la deuxième molaire
inférieure avec exposition progressive de la table interne de la mandibule.
Figure 3 Examen tomodensitométrique (cas n° 3) : lyse osseuse dans la région
de la première molaire supérieure droite 6 mois après l’extraction, accompagné
d’une sinusite chronique homolatérale.
Ostéonécrose des maxillaires chez des patients traités
par bisphosphonates
La modification de la posologie des bisphosphonates
après l’apparition d’une ostéonécrose ne peut pas avoir
une incidence favorable immédiate sur l’évolution de la
lésion:en effet,les bisphosphonates absorbés n’ayant pas
été métabolisés, ils continuent à agir probablement
encore longtemps après l’arrêt du traitement; à titre
d’exemple, la demi-vie osseuse de l’alendronate varie
entre 1 à 10 ans selon le turn-over osseux20.
La physiopathologie de ces ostéonécroses n’est pas
totalement élucidée et plusieurs hypothèses sont évoquées.
Les bisphosphonates agissent sur les ostéoclastes
et provoquent une diminution du remodelage
osseux, donc une augmentation de la minéralisation
osseuse21 et, secondairement, une diminution de la
vascularisation osseuse comme dans toute affection
ostéo-condensante. L’effet anti-angiogénique, propre
aux aminobisphosphonates (principalement le zolédronate)
5, pourrait participer à la diminution de la
vascularisation. Les ostéonécroses sont donc très certainement
d’origine ischémique et, comme les bisphosphonates
ne sont pas métabolisés, le degré de
minéralisation et d’ischémie est sans doute en rapport
direct avec la dose cumulée.
D’autres facteurs, hormis ceux évoqués ci-dessus, ont
peut être un rôle pour expliquer la localisation exclusive
aux maxillaires. Dans les cas publiés, on trouve
peu de précisions sur les raisons qui ont motivé les
extractions dentaires qui, pour la plupart des auteurs,
auraient déclenché le processus d’ostéonécrose. Le
plus souvent, il semble plutôt s’agir d’un accident
infectieux ou inflammatoire, favorisé par l’ostéonécrose;
dans cette hypothèse, l’extraction dentaire révélerait
l’existence de l’ostéonécrose et elle n’en serait
donc pas la cause directe.
La présence d’une dent avec une atteinte
parodontale – ce qui signifie l’existence
d’une solution de continuité de la
muqueuse – favorise la contamination, à
partir de la flore buccale, de l’os en voie de
nécrose et cette contamination pourrait
même participer à l’apparition et l’extension
du processus de nécrose.
Comme dans la plupart des cas publiés,
le traitement comportait aussi une chimiothérapie
et/ou une radiothérapie ;
certains auteurs en ont déduit que les
bisphosphonates joueraient seulement le
rôle de co-facteur19. Cette hypothèse
étiopathogénique ne permet pas d’expliquer
les cas où on ne retrouve pas cette
association thérapeutique (par exemple,
le troisième et le huitième cas dans notre
Figure 4 Scintigraphie osseuse au Tc 99m (cas 1) montrant plusieurs
foyers hypercaptants. Cet examen ne permet pas de différencier
la nature des foyers : les foyers costaux font suspecter une origine
tumorale, celui du maxillaire correspond à l’inflammation induite
par l’ostéonécrose étendue ; cette inflammation touche même
le sinus maxillaire gauche.
Figure 5 Séquestre osseux d’aspect caractéristique (cas n° 1) : les travées, à bords
irréguliers, présentant un remaniement ostéoclasique sans ostéoclastes ; les logettes
ostéocytaires sont vides et, par endroits, on observe des amas de germes.
série). Il semble que l’ostéonécrose résulte principalement
d’une augmentation excessive de la minéralisation
secondaire à une dose accumulée de bisphosphonates
trop importante. Il serait donc souhaitable
d’entreprendre des investigations complémentaires
pour préciser le mode d’action et la demivie
des bisphosphonates, afin de trouver la posologie
la mieux adaptée pour chaque patient et/ou
pour chaque affection. Enfin, tant que les mécanismes
physiopathologiques de cette ostéonécrose
ne seront pas mieux connus, on ne pourra pas
s’empêcher de faire un parallèle avec l’ostéonécrose
des maxillaires due à la toxicité du phosphore22.
En attendant ces précisions, avant de prescrire des bisphosphonates,
le patient doit être informé de cette complication
éventuelle et éliminer les facteurs favorisants
potentiels.Les interventions de chirurgie implantaire doivent
être également déconseillées aux sujets en cours de
traitement23 ou ayant été traités récemment. Une mise
en état de la denture (soins d’hygiène et élimination des
foyers infectieux bucco-dentaires, traitement des caries,
contrôle de l’adaptation des prothèses amovibles)
devrait être réalisée systématiquement afin de limiter les
interventions et les soins dentaires pendant le traitement.
Lorsqu’un foyer d’ostéonécrose est apparu, il
semble judicieux de procéder, sans trop tarder, à l’ablation
de l’os nécrosé. C’est la meilleure façon de supprimer
l’exposition osseuse car sa persistance favorise l’infection
et entraîne une augmentation probable de la
taille du séquestre.
Références
1 Rogers MJ. From molds and macrophages to mevalonate: a decade of
progress in understanding the molecular mode of action of
bisphosphonates. Calcif Tissue Int 2004; 75: 451-61.
2 Russell RG, Rogers MJ. Bisphosphonates: from the laboratory to the clinic
and back again. Bone 1999; 25: 97-106.
3 Senaratne SG, Pirianov G, Mansi JL, Arnett TR, Colston KW.
Bisphosphonates induce apoptosis in human breast cancer cell lines.
Br J Cancer 2000; 82: 1459-68.
4 Amital H, Applbaum H, Aamar S, Daniel N, Rubinow A. Sapho syndrome
treated with pamidronate: an open-label study of 10 patients.
Rhumatology 2004; 43: 658-61.
5 Bezzi M, Hasmim M, Bieler G, Dormond O, Ruegg C. Zolendronate
sensitizes endothelial cells to tumor necrosis factor-induced programmed
cell death: evidence for the suppression of sustained activation of focal
adhesion kinase and protein kinase B/Akt. J Biol Chem 2003; 278:
43603-14.
6 Recommandations de l’Afssaps. Traitement médicamenteux de
l’ostéoporose cortisonique. Med Therap 2004; 10: 63-71.
7 Recommandations de l’Afssaps. Traitement de l’ostéoporose post
ménopausique. (actualisation octobre 2004).
http.//afssaps.sante.fr/htm/5/rbp/indrbp.htm
8 Facon T, Gastinne T, Leleu X. Myélome multiple: espoirs thérapeutiques.
Rev Prat 2003; 17: 515-17.
9 Brown JE, Neville-Webbe H, Coleman RE. The role of bisphoshonates in
breast and prostate cancers. Endocrine-Related Cancer 2004; 11: 207-24.
10 Agarwala S, Sule A, Pai BU, Joshi VR. Alendronate in the treatment of
avascular necrosis of the hip. Rheumatology 2002; 41: 346-7.
11 Marx R. Pamidronate (Aredia) and Zoledronate (Zometa) induced avascular
necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003; 61:
1115-17.
12 Ruggiero SL, Mehrotra B, Rosenberg TJ. Osteonecrosis of the jaws
associated with the use of bisphosphonates: a review of 63 cases.
J Oral Maxillofac Surg 2004; 62: 527-34.
13 Carter GD, Goss AN. Bisphosphonates and avascular necrosis of the jaws.
Aust Dent J 2003; 48: 268.
14 Migliorati CA. Bisphosphonates and oral cavity avascular bone necrosis.
J Clin Oncol 2003; 21: 4253-4.
15 Pogrel A. Bisphosphonates and bone necrosis. J Oral Maxillofac Surg 2004;
62: 391-2.
16 Lugassy G, Shaham R, Nemets A, Ben-Dor D, Nahlieli O. Severe
osteomyelitis of the jaw in long-term survivors of multiple myeloma: a new
clinical entity. Am J Med 2004; 117: 440-1.
17 Greenberg MS. Intravenous bisphosphonates and osteonecrosis.
Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004; 98: 259-60.
18 Reid IR, Davisdson JS, Wattie D, Wu F, Lucas J, Gamble GD, Rutland MD,
Cundy T. Comparative responses of bone turnover markers to
bisphosphonate therapy in Paget’s disease of bone. Bone 2004; 35: 224-30.
19 Tarassoff P, Csermak K. Avascular necrosis of the jaws: risk factors in
metastatic cancer patients. J Oral Maxillofac Surg 2003; 61: 1238-9.
20 Lin JH. Bisphosphonates: a review of their pharmacokinetic properties.
Bone 1996; 18: 75-85.
21 Nyman JS, Yeh OC, Hazelwood SJ, Martin RB. A theoretical analysis of longterm
bisphosphonate effects on trabecular bone volume and
microdamage. Bone 2004; 35: 296-305.
22 Hellstein JW, Marek CL. Bis-phossy jaw, phossy jaw, and the 21st century:
bisphosphonate-associated complications of the jaws. J Oral Maxillofac
Surg 2004; 62: 1563-66.
23 Starck WJ, Epker BN. Failure of osseointegrated dental implants after
diphosphonate therapy of osteoporosis: a case report. Int J Oral Maxillofac
Implants 1995; 10: 74-8.